12. 配位子交換能の差で分離
12-1. 配位子とは
錯体の中で中心の金属イオンに結合している分子やイオンの総称です。HPLCにおける配位子交換能とは、官能基の対イオン(金属イオン)と糖の水酸基との間で形成される錯体の強さ(錯形成能)のことです。
12-2. 配位子交換モード(配位子交換クロマトグラフィー)の分離機構
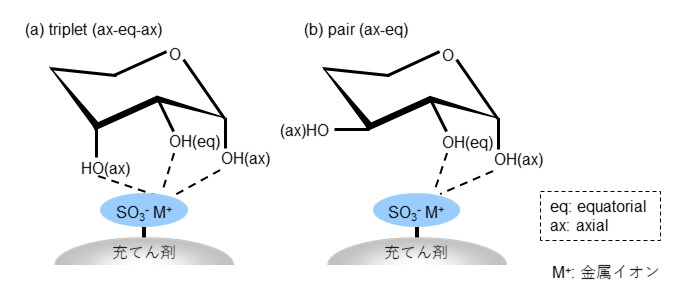
配位子交換能の差を利用した配位子交換モードは主に糖分析で利用されています。糖は多数の水酸基をもつアルデヒド(アルドース)又はケトン(ケトース)で、エネルギー的に安定なイス型配座の環状構造をとることが知られています。各炭素に結合している水酸基はその結合位置により水平方向 (equatorial位)や垂直方向 (axial位)に配置されますが、糖の種類によって水酸基の立体配置は異なります。配位子交換モードに用いる充てん剤には官能基としてスルホ基が結合し、このスルホ基に対イオン(カウンターイオン)として金属イオンが結合しています。金属イオンは糖の水酸基と間で錯体を形成しますが、水酸基の立体配置によって錯体の強さが異なります。図25に配位子交換モードの分離機構を示します。(a)の立体配座では3つの水酸基が金属イオンと錯体形成 (triplet)しますが、(b)の立体配座では2つの水酸基で錯体 (pair)を形成するため、(a)よりも弱い錯体となります。配位子交換モードでは錯生成能が小さい糖ほど溶出が早くなります。
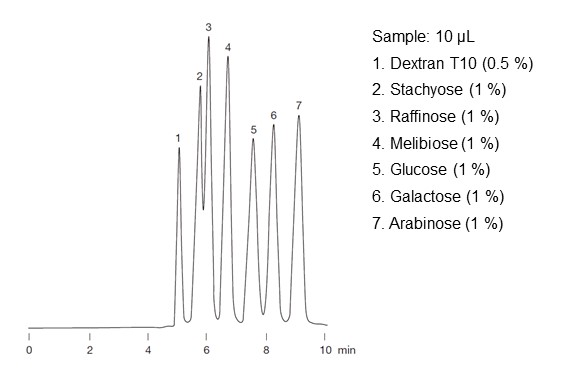
実際の糖分析は、配位子交換モードのみではなく、サイズ排除モード(後述)や前述のHILICモードとの組み合わせで分離が行われます。このため、錯生成能に差がない場合でも分子サイズや極性が異なれば分離が可能となりますし、逆にサイズ排除モードやHILICモードだけでは分離できない場合でも配位子交換モードを組み合わせることで分離できる場合もあります。図26に配位子交換モードとサイズ排除モードを組み合わせた糖の溶出順序を示します。サイズ排除モードの働きにより糖は分子量が大きい順番に溶出していますが、グルコース(ピーク番号5)とガラクトース(ピーク番号6)は単糖類で立体異性体の関係です。両者は分子量が同じでサイズ排除モードだけでは分離できませんが、配位子交換モードの働きにより分離できています。
配位子交換モードは、この錯形成能の違いを利用して単糖同士や二糖同士などの異性体分離に適しています。
- Column
- :Shodex SUGAR SC1011 (8.0 mm I.D. x 300 mm)
- Eluent
- :H2O
- Flow rate
- :1.0 mL/min
- Detector
- :RI
- Column tamp.
- :80 ℃
配位子交換モードに用いる金属イオンは色々あり、錯形成能は金属イオンの種類によっても異なります。対イオンにおける錯体形成能の強さの順はおおむね次の通りです。
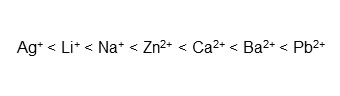
Shodexでは、カルシウムイオン (Ca2+)、鉛イオン (Pb2+)、亜鉛イオン (Zn2+)、ナトリウムイオン (Na+)の配位子交換用カラムをラインアップしています。
Shodexの配位子交換モードとサイズ排除モードを組み合わせたカラムはこちら
Shodexの配位子交換モードとHILIC除モードを組み合わせたカラムはこちら
カラムによって分離可能な糖の組み合わせが異なります。各カラムでの「糖の保持容量」をまとめたページを用意していますのでご参考ください。
13. 分子サイズ(分子量)の差で分離
これまでに紹介してきた分離モードは、いずれも充てん剤と分析種間の相互作用を利用して分離を行うものですが、ここで説明するサイズ排除モードは相互作用の利用とは異なり、物理的な性質(分子サイズ)を利用した分離方法となります。
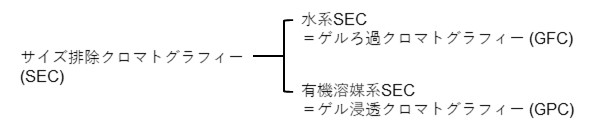
13-1. サイズ排除モード(サイズ排除クロマトグラフィー)の命名
サイズ排除クロマトグラフィー (Size exclusion chromatography; SEC)は1955年にイギリスのG. H. LatheとC. R. J. Ruthvenの開発からスタートしました。その後、1959年にスウェーデンのJ. PorathとP. Flodinが架橋デキストラン粒子を用いたタンパク質の分離と脱塩に関する論文を発表し、論文中でゲルろ過クロマトグラフィー (Gel filtration chromatography; GFC)を命名しました。1964年にはアメリカのJ. C. Mooreがポリスチレン (PS)粒子を用いた合成高分子の分子量分布測定法を発表し、ゲル浸透クロマトグラフィー (Gel permeation chromatography; GPC)と命名しました。この頃から使用する溶離液よってGFC、GPCと分けて呼ばれるようになりましたが、近年は学術用語としてはSECに統一されており、溶離液に水溶液を用いる場合を水系SEC、有機溶媒を用いる場合を有機溶媒系SECなどとも呼ばれています。
13-2. サイズ排除 (SEC)モードの分離機構
充てん剤には多数の細孔(ポア)が存在し、SECモードはこの細孔を利用して分析種を分離します。SECモードの分離機構は細孔を円錐形に見立てて次のように説明されます。図28の(a)のように細孔は奥に進むほど径が狭くなるため、分子サイズの小さい分析種(青)は細孔の奥まで入り込めますが、分析種の分子サイズが大きくなるに従って細孔の途中までしか入り込めず(紫、緑)、さらに分子サイズが大きくなると細孔に全く入れなくなり、充てん剤の表面だけを通過してカラムから最初に溶出します。(オレンジ、ピンク)。細孔に入り込める分析種は細孔への出入りを繰り返しながらカラムの中を通過するため、細孔への入り込みが深い分子サイズの小さい分析種ほどカラム内の移動距離が長くなります。さらにSECモードは相互作用のない条件下が前提のため、各分析種の移動速度が一定であることから図28の(b)のようにSECモードでは分子サイズの大きい分析種の順番に溶出します。
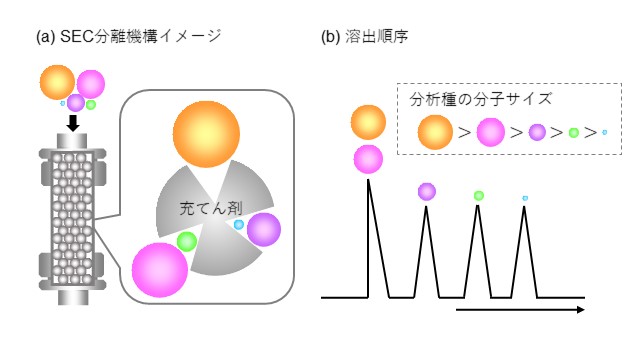
図29にSECモードによる標準タンパク質の分離例を、図30にポリカーボネートの分離例を示します。タンパク質のように単分散(単一の分子量で構成)の分析種ではそれぞれピークとして現れます。一方、合成高分子や多糖など分子量の分布を持った集合体では1つのピークとして現れますが、SECモードの働きにより分子サイズの大きい順番に溶出して1つのピークを形成しています。
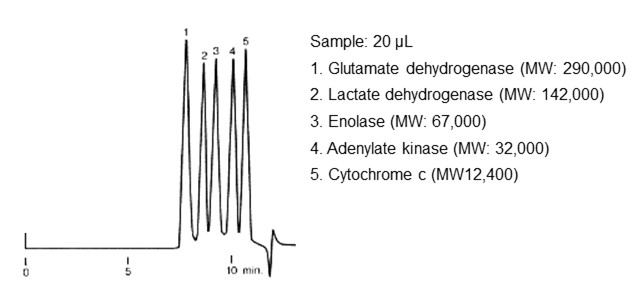
- Column
- :Shodex PROTEIN KW-803 (8.0 mm I.D. x 300 mm)
- Eluent
- :
50 mM Phosphate buffer (pH7.0) + 0.3 M NaCl - Flow rate
- :1.0 mL/min
- Detector
- :UV (280 nm)
- Column tamp.
- :Room temp.
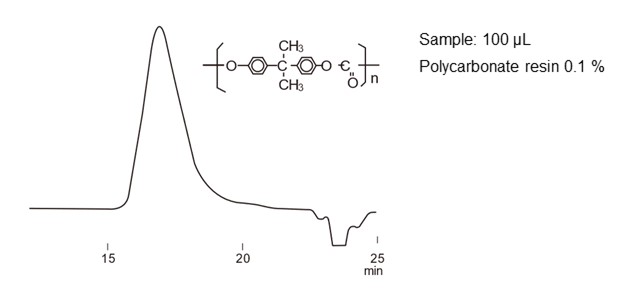
- Column
- :Shodex GPC KF-806L (8.0 mm I.D. x 300 mm) x 2
- Eluent
- :THF
- Flow rate
- :1.0 mL/min
- Detector
- :RI
- Column tamp.
- :40 ℃
13-3. 分子量測定
高分子の物性を知る上で分子量や分子量分布を求めることは重要です。SECモードは高分子の分子量や分子量分布の測定目的で用いられることも多く、分析結果から数平均分子量 (Mn)や重量平均分子量 (Mw)、多分散度 (Mw/Mn)などの情報が得られます。 SECモードを用いた分子量分布測定では、分析種と同じ分析条件で分子量が既知の標準試料を分析し、各標準試料の分子量とピークトップの保持時間(保持容量)の関係をプロットした較正曲線と呼ばれるグラフを作成します。この較正曲線は高分子ピークの溶出位置を分子量に換算するために用います。
ここで重要なのはSECモードは分子サイズの違いを利用した分離モードであるということです。分子量が同一でも分子構造が異なる高分子同士では分子サイズが同一とは限りません。分子サイズが異なれば分子量が同一でも溶出位置は異なるため、本来は測定対象の高分子と同じ構造の標準試料を用いる必要がありますが、現実的にはそれぞれの高分子に対応した標準試料を用意することは難しく、市販の標準試料から分子構造や溶解性が近いものを選んで較正曲線を作成します。このため、較正曲線から得られる分子量情報は使用する標準試料の分子量、すなわち「相対分子量」となります。
Shodexでは、水系SEC用標準試料としてプルランを、有機溶媒系SEC用標準試料としてポリスチレン (PS)とポリメチルメタクリレート (PMMA)をラインアップしています。
Shodexの水系SEC(GFC)用標準試料はこちら
Shodexの有機溶媒系SEC(GPC)用標準試料はこちら
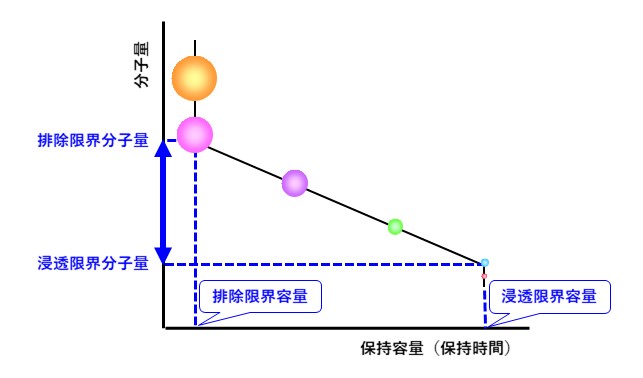
図31に較正曲線のモデル図を示します。先述の通り、細孔に入らない大きな高分子(オレンジ、ピンク)は分子量(分子サイズ)が異なっていてもまとめて溶出します。この位置に溶出する高分子は分子サイズの差を利用した分離はできません。この溶出位置を「排除限界容量」と言い、この位置に溶出する高分子の中で最も小さい分子量を「排除限界分子量」と言います。一方、一定の分子サイズよりも小さい分析種もすべて細孔の奥まで入り込み、まとめて最後に溶出するため分離ができません。この溶出位置を「浸透限界容量」と言い、この位置に溶出する高分子の中で最も大きい分子量を「浸透限界分子量」と言います。
高分子の分子量分布測定を行う場合は、高分子の構成成分が排除限界容量(および浸透限界容量)に掛からないカラムを選択することが重要です。
SECモード用カラムは様々なポアサイズを有するカラムがラインアップされています。
ウェブサイトやカタログ等に参考値としてカラムの排除限界分子量の他、SEC分析に適した分子量範囲も記載していますのでカラム選択の参考にご利用ください。
Shodexの水系SEC(GFC)用カラムはこちら
Shodexの有機溶媒系SEC(GPC)用カラムはこちら
Shodexでは、SECモードを主体として溶離液の選択により逆相モードやHILICモード、イオン交換モードなどが複合的に働くマルチモード用カラムや水系、有機溶媒系の両方で使用可能なSECカラムもラインアップしています。
Shodexのマルチモード/水・有機溶媒両用SEC用カラムはこちら
14. 特異性の差で分離
分離モードには試料の特異性を利用したものがあります。ここでは、光学分割とアフィニティークロマトグラフィーについて簡単に紹介します。
14-1. 光学分割
鏡像異性体(エナンチオマー)はお互いが鏡で写したような対称的な構造をもつ立体異性体の1つです。重ね合わせることができない関係で、右手と左手をイメージすると分かりやすいと思います。鏡像異性体の一方は光を当てると右に曲げる性質(右旋性)があり、他方は左に曲げる性質(左旋性)があることから鏡像異性体は光学異性体とも呼ばれています。光学異性体は、物理的性質や化学的性質は全く同じでも人体に摂取された場合に異なる作用(生理活性)を示す場合があります。例えばL-グルタミン酸ナトリウムはうま味調味料として有名ですが、光学異性体のD-グルタミン酸ナトリウムはほぼ無味でうま味調味料にはなりません。このように一方は有用な生理活性を示すが、もう一方は示さない、時には人体に悪影響を与えてしまう場合があります。製薬の原料には光学活性体のものがあります。製造工程で光学活性体を合成する場合、目的の光学活性体だけを合成することは難しく、光学異性体も同時に合成されることが多いため、光学異性体の分離は非常に重要となります。光学異性体をクロマトグラフィーで分離することを光学分割と言います。
光学分割を行う相互作用にはいくつかのタイプがありますが、Shodexの光学分割用カラムは、環状オリゴ糖であるβ-シクロデキストリンの誘導体をリガンドとしたホスト-ゲスト型カラムです。分析種はβ-シクロデキストリンの空孔に取り込まれて包接錯体を形成しますが、光学異性体の包接錯体能の違いを利用して光学異性体を分離します。
Shodexの光学分割用カラムはこちら
14-2. アフィニティークロマトグラフィー
アフィニティークロマトグラフィーの分離機構は、鍵と鍵穴の関係に例えられます。充てん剤に結合しているリガンドを鍵穴、分析種を鍵と見立て、鍵穴に合った鍵のみが解錠できるようにリガンドと生化学的な親和性をもつ特定の分析種のみが保持され他の成分は保持されません。分析種を溶出させる時は溶離液組成を変更してリガンドから解離させます。このようにアフィニティークロマトグラフィーは非常に選択性が高く、分析種の単離・生成に優れた分析手法ですが、分析種ごとにリガンド、保持条件、解離条件を設定する必要があります。
